Фенол
Фенол, который также называют гидробензолом, или карболовой кислотой, является самым простейшим представителем класса фенолов. В чистом виде представляет из себя игольчатые белые кристаллы, при контакте с воздухом приобретающие розовый оттенок. Фенол имеет ярко выраженный резкий запах, а также обладает высокой токсичностью: достаточно одного незащищенного контакта с чистым фенолом, чтобы на коже и слизистых остались сильные химические ожоги. И все же фенол активно производят во всем мире благодаря его промышленному и медицинскому применению.


Фенол используется для производства бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол, фенолформальдегидных смол, также гидрированием он превращается в циклогексанол, используемый для получения искусственных волокон - нейлона и капрона, а также для других нужд, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ - полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине как обезболивающее и антисептическое средство.
Фенол и его производные обуславливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах.
|
Систематическое наименование |
Гидроксибензол |
|
Традиционные названия |
Фенол, карболовая кислота, карбо́лка, бензоло́л; оксибензо́л |
|
Хим. формула |
C6H6O |
|
Рац. формула |
C6H5OH |
|
Физические свойства |
|
|---|---|
|
Состояние |
Твёрдое |
|
Молярная масса |
94,11 г/моль |
|
Плотность |
1,07 г/см³ |
|
Энергия ионизации |
8,5 ± 0,1 эВ |
|
Термические свойства |
|
|
Температура |
|
|
плавления |
41 °C |
|
кипения |
181,84 °C |
|
вспышки |
79 (в закрытом тигле), 85 (в открытом) °C |
|
Пределы взрываемости |
1,8 ± 0,1 об.% |
|
Мол. теплоёмк. |
134,7 (кр.) Дж/(моль·К) |
|
Энтальпия |
|
|
образования |
−162,944 кДж/моль |
|
Давление пара |
0,4 ± 0,1 мм рт.ст. |
|
Химические свойства |
|
|
Константа диссоциации кислоты |
9,89 ± 0,01 |
|
Растворимость
|
|
|
в воде |
6,5 г/100 мл |
|
Структура |
|
|
Гибридизация |
sp2-гибридизация |
|
Классификация |
|
|
Рег. номер CAS |
108-95-2 |
Фенол - токсичное вещество. По степени воздействия на человеческий организм фенол относится к высокоопасным веществам (Класс опасности 2). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют.
Предельно допустимые концентрации (ПДК) фенола:
- ПДКр.з. = 1 мг/м³ (2 класс опасности)
- ПДКр.с. = 0,3 мг/м³ (2 класс опасности)
- ПДКм.р. = 0,01 мг/м³
- ПДКс.с. = 0,006 мг/м³
- ПДКв. = 0,001 мг/л.
Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом - паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Смертельная доза для человека при попадании внутрь - 1-10 г, для детей - 0,05-0,5 г.
Охрана труда
ПДК в воздухе рабочей зоны - 1 мг/м³ (максимально-разовая) и 0,3 мг/м³ (среднесменная). Порог восприятия запаха фенола может достигать (среднее значение в группе) 5,8-7,5 мг/м³, у отдельных работников он может быть значительно больше среднего значения.
Основное количество используемых фенола, крезолов и ксиленолов получают из жидких продуктов коксования, полукоксования и гидрогенизации бурого и каменного углей, а также из сточных вод этих производств.
Существуют следующие способы извлечения фенолов:
- экстракция едким натром из смол переработки угля;
- экстракция сульфидом натрия из фенолосодержащих масел жидких продуктов перегонки;
- экстракция водным метанолом;
- экстракция бутилацетатом или смесями эфиров высших алифатических спиртов из сточных вод (фенолосольватный способ).
Для извлечения фенолов наиболее широко применяется экстракция метанолом и его водными растворами из фракций смол коксования и полукоксования углей, а также щелочная экстракция из фракций каменноугольной смолы. Щелочной способ обеспечивает наиболее полное и селективное извлечение фенолов, но связан с необратимым расходованием больших количеств достаточно дорогой щелочи.


Выделение фенолов из продуктов нефтепереработки
При каталитическом крекинге нефти выделяют смесь побочных продуктов – фенолы, крезолы, ксиленолы, высококипящие фенольные соединения, из которых фенол и его гомологи извлекают для дальнейшей переработки. Добавление воды к нефти приводит к увеличению выхода фенола: в присутствии 5% воды он возрастает вдвое. Повышение температуры крекинга вызывает более интенсивное фенолообразование. Бензол в настоящее время является основным сырьем для производства фенола. В последние годы для синтеза фенола стали использовать значительно более дешевый продукт – толуол.
В промышленности фенол получают следующими способами:
- сульфированием бензола с последующим щелочным плавлением бензолсульфокислого натрия;
- щелочным гидролизом хлорбензола (процесс фирмы "Дау Кемикал);
- модифицированным способом Рашига (процесс фирмы "Хукер Кем");
- кумольным способом (разложение пероксида кумила на ацетон и фенол); - окислением бензола.
Синтез фенолов через сульфирование бензола
Реакция взаимодействия бензолсульфокислого натрия и едкого натра была открыта А. Вюрцем и А. Кекуле еще в 1867 г.

Сульфирование бензола осуществляют пропусканием его через концентрированную серную кислоту при 423 К. Образующаяся бензолсульфокислота нейтрализуется сульфатом натрия, выделяющимся при щелочном плавлении, или карбонатом натрия:

Окончательную нейтрализацию проводят карбонатом кальция, причем выделяющийся СО2 затем используют для нейтрализации раствора фенолята натрия. Оксид серы (IV) и пары воды, образующиеся по реакции, служат для выделения фенола из раствора фенолята:

В качестве побочных продуктов образуются гидроксидифенилы, дифенилсульфон, дифениловый эфир, дифенилсульфид, карбонат натрия, гипс. Достоинством этого способа является простое аппаратурное оформление, чистота получаемого фенола, практически не содержащего серы, и высокий выход продукта более 90%.
Щелочной гидролиз хлорбензола (процесс фирмы "Дау Кемикал").
В 1872 г. Дусарт и Барди показали, что при 573 К хлорбензол разлагается водным раствором едкого натра на фенолят натрия и хлорид натрия. Позднее Эйлсворту удалось осуществить непрерывный процесс гидролиза хлорбензола водным раствором щелочи путем подачи смеси реагентов при 613-663 К через систему труб при высоком давлении. Процесс описывается следующими схемами:

Реакцию проводят следующим образом: хлорбензол и едкий натр поступают в смеситель, в котором они интенсивно перемешиваются. После этого реагенты подают в автоклав насосами высокого давления. Реакция протекает при 613-663 К и 28,0-30,0 МПа.
Модифицированный способ Рашига (процесс фирмы "Хукер Кем").
Этот процесс проводят в две стадии. На первой стадии бензол превращается в хлорбензол путем пропускания через него хлорида водорода и воздуха в присутствии хлоридов меди и железа, являющихся катализаторами:

На второй стадии происходит омыление хлорбензола водяным паром при 773 К в присутствии кремневой кислоты:

Суммарно реакция описывается следующим уравнением:

1935-1945 гг. фирмой "Хукер Кем" был освоен промышленный метод получения фенола по способу Рашига. Принципиальная технологическая схема процесса представлена на рисунке. Хлорирование бензола проводят в стальном реакторе 4 с воздушным охлаждением при 503 К. Для этого бензол нагревают до 563 К и перемешивают горячим воздухом (423 К) с соляной кислотой, нагретой до 383 К. Соотношение бензол:воздух:16,5%-ная соляная кислота составляет 10:2,18:3,05 (мас. ч.). Смесь при 783 К подают в реактор 4 для хлорирования, из которого тепло отводят с помощью воздушного охлаждения.

Принципиальная технологическая схема получения фенола по cпособу Рашига.
1 - холодильник; 2 - смеситель; 3 - разделитель; 4 - реактор хлорирования; 5 - подогреватель; 6 - гидролизный аппарат; 7-11 – аппараты очистки; 12, 13 – аппараты выделения фенола. Потоки: I - бензол; II - соляная кислота; III - хлорбензол; IV - дихлорбензол; V - вода; VI - водный раствор HCl; VII – хлорбензол + вода; VIII – фенол + вода; IX – бензол + хлорбензол; X - отходящие газы; XI - воздух; XII - фенол; XIII – фенол + хлорбензол + вода + HCl; XIV - полифенилины
Катализатор хлорирования получают осаждением оксида алюминия из раствора алюмината натрия под воздействием солянокислого раствора CuCl/FeCl3. Традиционные катализаторы, получаемые пропиткой оксида алюминия хлоридами меди и железа, здесь непригодны. Гидролиз хлорбензола проводят водяным паром при 693 К в присутствии трифосфата кальция. Выход фенола составляет ~ 80% при степени конверсии на каждой из стадий 10-15%. Преимуществами процесса фирмы "Хукер" по сравнению со способом Рашига является более высокая селективность, связанная с применением эффективного катализатора. Коррозия аппаратуры предотвращается использованием наряду с керамическими материалами хрома и тантала.
Кумольный метод.
Оригинальный метод синтеза фенолов кислотным разложением гидропероксидов, получаемых окислением жирноароматических углеводородов, был открыт при исследовании получения ацетофенона из гидропероксида изопропилбензола (гидропероксид кумила) П.Г. Сергеевым, Б.Д. Кружаловым и Р.Ю. Удрисом и М.С. Немцовым в 1942 г. и реализован в г. Дзержинске в 1949 г.
Промышленное получение фенола указанным способом освоили также фирмы "Геркулес Паудер" (США) и "Дистиллерс" (Англия). Кумольный способ производства фенола занимает в настоящее время ведущее место.
Процесс может быть описан следующей схемой:

Принципиальная технологическая схема процесса получения фенола из бензола и пропилена представлена на рисунке. Процесс состоит из нескольких стадий.

Принципиальная технологическая схема получения фенола из кумола (бензола и пропилена).
1 - реакторы; 2 - аппарат для гидрирования; 3 - концентратор; 4 - аппарат для промывки; 5 - колонна выделения ацетона; 6 - колонна выделения кумола; 7 - колонна выделения а-метилстирола; 8 - колонна выделения фенола; 9 - разделитель.
Потоки: I – воздух; II – щелочь; III – кумол; IV – вода; V – серная кислота; VI – ацетон; VII – раствор соды; VIII - -метилстирол; IX – фенол; X – смола
На первой стадии путем алкилирования бензола пропиленом получают кумол (изопропилбензол):

Хотя для синтеза фенола можно использовать этил-, бутил-, изопропил- и изобутилпроизводные, промышленное значение имеют пока только изопропилпроизводные. На второй стадии полученный кумол окисляют кислородом или воздухом в достаточно стабильный гидропероксид кумила:

Далее гидропероксид кумила концентрируют, поскольку при окислении протекают процессы его распада, которые не позволяют доводить концентрацию в оксидате до значительных величин. И наконец, проводят каталитическое кислотное разложение гидропероксида кумила на фенол и ацетон:
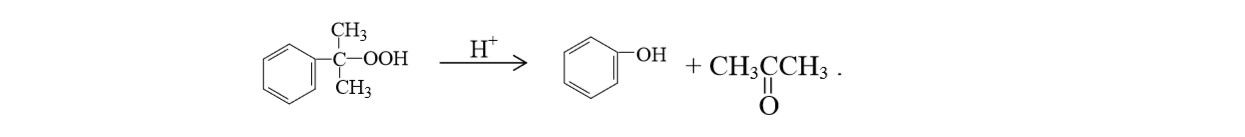
После этого реакционную массу разделяют для получения индивидуальных ацетона, фенола и выделения побочных продуктов.
Алкилирование бензола пропиленом
Алкилароматические углеводороды могут быть получены алкилированием бензола различными алкилирующими агентами: олефинами, спиртами, алкилгалогенидами. Однако спирты и алкилгалогениды как алкилирующие агенты довольно дороги и при осуществлении крупнотоннажного производства не перспективны. Поэтому в настоящее время практическое значение имеет только алкилирование олефинами. Катализаторами процесса алкилирования служат протонные и апротонные кислоты: серная и фосфорная кислоты; фосфорная кислота, нанесенная на носитель; хлорид алюминия и фторид бора; фтороводородная кислота; цеолиты. Применение твердых катализаторов значительно упрощает подготовку сырья и особенно переработку реакционной массы: отпадает необходимость в нейтрализации и промывке. В то же время применение хлорида алюминия - наиболее распространенного в настоящее время катализатора - хотя и связано с рядом технологических трудностей (сушка сырья, образование НСl и хлоридов при промывке и нейтрализации алкилата), но позволяет обеспечить высокую селективность алкилирования за счет обратимой реакции диспропорционирования полиалкилбензолов в присутствии бензола:

Вследствие этого при использовании хлорида алюминия не только уменьшается выход полиалкилпроизводных, но и оказывается возможным перевод в моноалкилбензолы сравнительно небольшого количества образующихся ди- и полиалкилбензолов. В Советском Союзе наибольшее распространение получило алкилирование в присутствии AlCl3, в США - использование в качестве катализатора фосфорной кислоты на кизельгуре. Алкилирование - сильно экзотермический процесс и при температурах до 473-573 К равновесие практически полностью сдвигается в сторону образования продуктов реакции. Алкилирование ароматических углеводородов является последовательнопараллельным процессом и может протекать вплоть до образования гексазамещенных бензолов. Уувеличение количества олефина сдвигает состав продуктов алкилирования в сторону образования дизамещенных бензолов. Поскольку обычно целью процесса является получение моноалкипроизводного, используют избыток бензола и поддерживают невысокое содержание монопроизводных в реакционной массе – не более 25-35% (мол.).
Окисление изопропилбензола до гидропероксида
Окисление алкилароматических углеводородов кислородом воздуха протекает по радикально-цепному механизму. По возрастанию скорости окисления углеводороды можно расположить в ряд: первичный атом углерода < вторичный < третичный.
Скорость окисления по третичному атому углерода в алкилароматических углеводородах в 4 раза выше, чем по СН3-группе. В том же порядке увеличивается и стабильность соответствующих гидропероксидов. Механизм образования гидропероксидов описывается следующим образом:

Накопление гидропероксида при окислении алкилароматических углеводородов сопровождается образованием побочных продуктов - диметилфенилкарбинола и ацетофенона. Диметилфенилкарбинол образуется при термическом разложении кумилгидропероксида. Накопление побочных продуктов, и в особенности ацетофенона, становится заметным при значительных концентрациях гидропероксида в оксидате. Побочные продукты ускоряют распад гидропероксида, и на определенной ступени скорость его распада превышает скорость образования. Поэтому окисление проводят до относительно небольшой степени конверсии изопропилбензола: допустимая концентрация гидропероксида в оксидате не превышает 20-30%. Таким образом, при низких концентрациях гидропероксида возрастает селективность его образования. Например, при получении фенола уменьшение содержания гидропероксида в оксидате с 29 до 25% сокращает количество побочных продуктов в 2,2 раза. Концентрацию гидропероксида целесообразно поддерживать не выше 18%. Окисление можно проводить кислородом воздуха или чистым кислородом и при атмосферном, и при повышенном давлении, однако использование кислорода или повышенного давления воздуха приводит к образованию смолистых веществ. Поэтому, как правило, окислителем служит воздух, к чистоте которого предъявляют достаточно жесткие требования, так как даже незначительные примеси в воздухе (например, оксида серы) могут ингибировать окисление. Окисление можно проводить как при барботаже воздуха через безводный изопропилбензол, так и через эмульсию изопропилбензола в водно-щелочной среде. В обоих вариантах оформления процесса необходимо приблизить условия окисления к кинетической области путем обеспечения интенсивного барботажа окисляющего агента и тонкого диспергирования окисляемого вещества. Окисление в водно-щелочной эмульсии протекает с несколько большей скоростью, но связано со значительным увеличением объема аппаратов, поскольку объем водной фазы в 3-4 раза превышает объем окисляемого углеводорода. В качестве эмульгаторов обычно применяют стеарат натрия, а в качестве щелочного компонента – карбонат натрия. В России используют оба варианта.
Концентрирование гидропероксидов
Разложение гидропероксида в принципе можно проводить без концентрирования – в этом случае фенолы можно выделить ректификацией или экстракцией щелочью непосредственно из реакционной массы. Однако разложение гидропероксида в присутствии большого избытка непрореагировавшего углеводорода неизбежно приведет к образованию продуктов взаимодействия с углеводородом и, в конечном счете, к большим потерям гидропероксида и увеличению выхода побочных продуктов. Концентрирование гидропероксида осуществляют либо удалением непрореагировавшего углеводорода дистилляцией в вакууме, либо путем химических превращений гидропероксида. Дистилляция в вакууме – наиболее простой способ концентрирования, который находит наиболее широкое применение в производстве фенола. Обычно используются двух- или трехступенчатые схемы дистилляции. В первом случае отгон углеводорода производится в системе последовательно расположенных колонн, причем последняя из них работает при остаточном давлении ~49 Па. При дистилляции главная задача – поддерживать в системе температуру не выше 373 К, чтобы уменьшить разложение гидропероксида.
Кислотное разложение гидропероксидов
Кислотное разложение гидропероксидов протекает по следующей схеме:

В зависимости от природы гидропероксида получают фенол и различные оксосоединения. Так, арилизопропилгидропероксиды образуют при разложении фенолы и ацетон, фенил-втор-бутилгидропероксид – фенол и метилэтилкетон; толилэтилгидропероксид – крезолы и ацетальдегид.
Выход фенолов в расчете на превращенный гидропероксид зависит от чистоты гидропероксида. При разложении гидропероксида 98-99%-й степени чистоты количественно образуются фенол и оксопроизводное. При концентрации гидропероксида 90-92% выход уменьшается до 94-97%, 87-88%-й гидропероксид дает 8890%-й выход фенола. При разложении технического гидропероксида, содержащего побочные продукты окисления, протекают побочные реакции, снижающие выход целевого продукта. Например, при взаимодействии фенола и диметилфенилкарбинола образуется кумилфенол:

Диметилфенилкарбинол отщепляет воду с образованием
а -метилстирола, который, в свою очередь, может алкилировать фенол, а также полимеризоваться, и особенно димеризоваться, с образованием линейного димера

Кроме этого, протекают реакции конденсации ацетона с образованием оксида мезитила, конденсации фенола и ацетона с образованием гидроксидифенилопропана, образование смолообразных продуктов. Для разложения гидропероксидов применяют сильные кислоты. Слабые кислоты вызывают разложение гидропероксида только при длительном пребывании при 373-393 К и значительном расходе кислоты. В промышленности чаще применяют серную кислоту, но могут быть использованы также фенолдисульфокислота, алкилфенолсульфокислота и др. Общим недостатком всех технологических вариантов кислотного разложения гидропероксидов является необходимость нейтрализации реакционной массы и выведения из нее солей, чтобы исключить коррозию и выпадение осадков в ректификационной аппаратуре. При нейтрализации и промывке образуются сточные воды, содержащие фенол и соли. Эти обстоятельства делают перспективным каталитическое разложение гидропероксида на твердых кислотах органического и неорганического происхождения. В качестве твердых катализаторов могут использоваться сильные катиониты (смолы типа КУ-2), которые разлагают гидропероксиды при 323-333 К. Однако их недостатком является быстрое уменьшение каталитической активности при относительно длительной эксплуатации в результате окислительной деструкции. Значительно более перспективно применение в качестве катализаторов твердых неорганических кислот. Они обладают высокой устойчивостью к действию окислителей. В качестве катализаторов могут быть использованы кислые природные глины (каолин, бентонит, мориллонит и др.), алюмосиликаты, кремнецирконевые катализаторы, цирконийфосфат.
Выделение фенола из продуктов разложения гидропероксида
Реакционная масса после разложения гидропероксида представляет сложную смесь фенола, ацетона, побочных продуктов превращения гидропероксида, смолистых веществ. Ректификация продуктов кислотного разложения кумилгидропероксида проводится в системе ректификационных колонн. Кроме ацетона и фенола выделяют метилстирол, а фенольную смолу направляют на сжигание или переработку. Такая система очистки позволяет получить фенол высокой степени чистоты с выходом 97% от ресурсов в сырье. Недостатки кумольного метода. Несмотря на прекрасно отлаженную технологию, кумольный метод имеет ряд недостатков. Прежде всего, это наличие взрывоопасного промежуточного соединения – гидропероксида кумила, а также многостадийность процесса. Так, при выходе целевого продукта 95% на каждой из трех стадий итоговый выход составляет лишь 86%. Однако основным и принципиально неустранимым недостатком кумольного метода является образование в качестве побочного продукта ацетона. Это обстоятельство становится все более серьезной проблемой, поскольку ацетон не находит эквивалентного рынка сбыта. В 1990-х годах это стало особенно ощутимым после создания новых способов синтеза метилметакрилата путем окисления углеводородов С4, что резко сократило потребность в ацетоне. В связи с проблемой утилизации ацетона в Японии разработана технология, предусматривающая его рецикл. С этой целью к традиционной кумольной схеме добавляют еще две стадии: гидрирование ацетона в изопропиловый спирт и дегидратация последнего в пропилена

Образующийся пропилен снова возвращают на стадию алкилирования бензола. В 1992 г. фирма "Мицуи" осуществила промышленную реализацию процесса мощностью 200 тыс. т/год по этой пятистадийной кумольной технологии. В настоящее время ведутся интенсивные исследования, ориентированные на поиск новых путей синтеза фенола, которые основывались бы на прямом окислении бензола. Работы проводятся главным образом в следующих направлениях: окисление молекулярным кислородом, окисление моноатомными донорами кислорода и сопряженное окисление.

